Acide orthophosphorique - exercice corrigé
Préparation d'une solution décimolaire d'acide orthophosphorique à partir d'une solution commerciale
1) C = n/V = m/MV = 1690*0.85/98 = 14.6 mol/L
2) On prélève à la pipette jaugée que l'on verse dans une fiole contenant un fond d'eau distillée. Puis on complète avec de l'eau distillée. L'utilisation d'une pipette et d'une fiole jaugée jaugée est nécessaire pour avoir une bonne précision.
3) Il faut toujours verser l'acide dans l'eau et non l'inverse, d'où la nécessité de mettre un fond d'eau dans la fiole.
Dosage de la solution d'acide orthophosphorique préparée :
- c'est un dosage acido-basique. Il faut donc utiliser une électrode de verre et une électrode de référence (calomel ou sulfate mercureux). Les électrodes de platine et d'argent sont utilisables en potentiométrie mais non en pH-métrie.
- Il faut effectuer l'étalonnage du pH-mètre à l'aide de 2 solutions étalon ( tampon pH 4 et 7 par exemple)
- a)La courbe de neutralisation présente 2 sauts de pH donc 2 équivalences.
- à la 2ème demi-équivalence on a pH = Pka2
Le volume de la demi équivalence est 7,5 mL ce qui correspond à pH = 7
Donc le pKa2= 7
4)a) On doit trouver pour les 2 équivalences le même volume de soude versé ce qui est bien le cas (aux erreurs de mesures près). Il vaut mieux utiliser la seconde équivalence car le volume versé est plus important et donc l'erreur plus faible.
b)Pour la soude V1eq = 5,05 mL et C1 = 1 mol/L
Pour l'acide V2 = 50 mL et C2 inconnue
A l' équivalence, on a C1V1eq = C2V2 → C2 = C1V1eq/V2 = 0.1 mol/L
5) a) PO43- + H2O ↔ HPO42- + OH-
b) détermination du coefficient de réaction
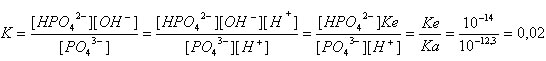
Tableau d'avancement:
PO43- + H2O ↔ HPO42- + OH-
t = 0 0,1 / 0 0
à l'équilibre 0,1 - x / x x
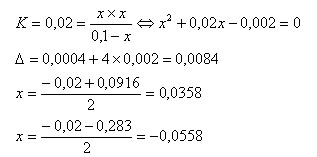 Seule la valeur positive est possible donc [OH-]= 0,0358 d'où [H+] = 10-14/0,0358=2,79.10-13 soit pH =12,55
Seule la valeur positive est possible donc [OH-]= 0,0358 d'où [H+] = 10-14/0,0358=2,79.10-13 soit pH =12,55