Loi de Raoult - exercice corrigé
- M = KC/ Δθ = 39*1/0,45 = 86,66 g/mol
Le composé contient comme élément C,H,O et N. On peut donc écrire sa formule brute sous la forme: CxHyOzNw.
Les pourcentages en masse du carbone s'écrit :
%C = x.MC/M avec MC la masse molaire du carbone.
On en déduit: x = 0,551* 86,66/12 = 3,98
Il y a donc 4 atomes de carbones dans la molécule.
Avec le même raisonnement pour les autre éléments on obtient:
y = 0,105*86,66/1 = 9,09 soit 9 atomes d'hydrogène
w = 0,159*86,66/14 = 0.98 soit 1 atome d'azote
Il ne reste plus qu'à déduire le nombre d'atomes d'oxygène:
z = (86,66 - 4*12-9*1-14*1)/16 = 15.66 soit 1 atome d'oxygène
2)
Pour déterminer les formules brutes, il peut être utile de calculer le nombre d'insaturation:
ni = (2*4+2 +1 - 9)/2 = 1 il y a donc soit 1 insaturation soit 1 cycle
La formule brute de la molécule est donc :
C4H9ON
Rappel: la fonction amide s'écrit R-CO-NH2 (ici une amide primaire)
-
fonction amide
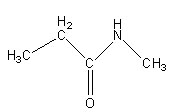 -
l'autre une fonction amine et une fonction aldéhyde
-
l'autre une fonction amine et une fonction aldéhyde
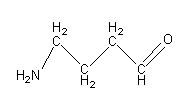
-
le 3ème un cycle à 3 chaînons
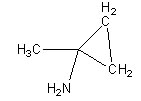
3) Dans le cas d'un analyse en spectrométrie de masse à ionisation électronique, la pic moléculaire aura une masse impaire si la molécule contient 1 atome d'azote