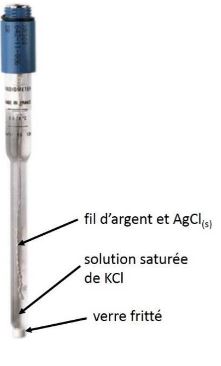
Electrode de référence : calomel et AgCl
Il existe plusieurs types d'électrode de référence. La plus couramment employée est celle au calomel saturé en raison de sa robustesse. Toutefois, la présence de mercure pose un problème de sécurité et environnemental. Elle est donc de plus en plus fréquemment remplacée par une électrode au chlorure d'argent.
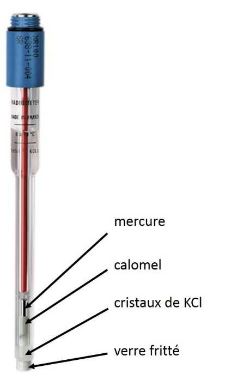
Electrode de référence : electrode au calomel saturé
Elle est constituée d'une électrode de mercure en contact avec du chlorure mercureux (Calomel) et du KCl saturé : Hg/ Hg2Cl2/KCl
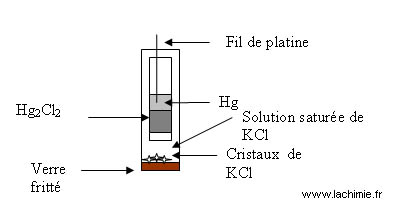
On a d'une part:
Hg22+ + 2e- ⇌ 2Hg
E = E° + 0,03 log [Hg22+]
Et d'autre part:
Hg2Cl2 ⇌ Hg22+ + 2Cl-
Ks = [Hg22+][Cl-]²
Le potentiel de l'électrode s'écrit donc en utilisant la relation de Nernst :
E = E° + 0,03 logKs -0,06 log[Cl-]
La concentration en ions Cl- est une constante puisque la solution est saturée en KCl. Le potentiel de l'électrode est donc constant et peut servir de référence.
Application numérique :
Solubilité de KCl = 4.6 mol/L
Ks = 10-17.9
E° = 0,797V
Le potentiel obtenu est 0,220 V.
Cette valeur est approximative car on a utilisé la concentration au lieu de l'activité et nous n'avons pas tenu compte de la température sur le potentiel standard.
La valeur du potentiel de l'électrode au calomel saturé, vaut en réalité : ECS = 0.2444 V
Electrode de référence Ag/AgCl
On a d'une part':
Ag+ + e- ⇌ Ag
E = E° + 0,059 log [Ag+]
Et d'autre part:
AgCl ⇌ Ag+ + Cl-
Ks = [Ag+][Cl-]
Le potentiel de l'électrode s'écrit donc :
E = E° + 0,059 logKs -0,059 log[Cl-]
Comme précédemment, la concentration en ions Cl- est une constante puisque la solution est saturée en KCl ou égale à 3 mol/L ou 1 mol/L.
Application numérique :
Solubilité de KCl = 4.6 mol/L
Ks = 10-9,75
E° = 0,766V
La valeur du potentiel de l'électrode est égal à : E = 0.199 V pour le KCl saturé
Avec KCl à 1 mol/L: E = 0.227 V
Précautions d'emploi : la jonction entre la solution à étudier et l'électrode s'effectue par un fritté poreux. Il faut impérativement éviter qu'un composé précipite dans le fritté et le bouche. Prenons par exemple le cas d'une solution contenant de l'argent : en présence des ions chlorures, AgCl va précipiter dans le fritté et boucher l'électrode. Pour palier à ce problème, on place une allonge de protection contenant une solution saline qui permet un contact électrique. On utilise le plus souvent une solution de KNO3 à 1 mol/L