Les effets des liaisons hydrogène en RMN
Pour rappel, les liaisons hydrogène sont dues à la polarité des liaisons. On les rencontre régulièrement sur les groupement hydroxyle O-H. L'oxygène étant plus électronégatif que l'hydrogène, ce dernier aura un déficit électronique δ+. Il va donc être attiré par un atome électronégatif voisin. Ce rapprochement est facilité par la petite taille de l'hydrogène. Les liaisons formées sont de faibles énergies et sont représentées par un trait en pointillé.
On peut facilement mettre en évidence la présence de ces liaisons sur des isomères en comparant leur point de fusion ou d'ébullition. En effet, les liaisons hydrogène apportent plus de stabilité.
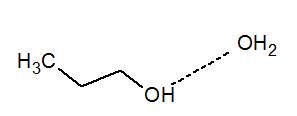
La concentration du composé à analyser peut avoir une influence sur le déplacement chimique en modifiant le nombre de liaison hydrogène. Celles-ci peuvent être de 2 types
: intermoléculaire et intramoléculaire.
La dilution dans le solvant va diminuer les associations entre les molécules et donc diminuer les liaisons hydrogènes intermoléculaires.
La densité électronique des protons va donc augmenter et on assiste à un déplacement vers les champs fort.
Inversement, une plus grande concentration du soluté va entraîner un déplacement vers les champs faibles.
Ce phénomène se retrouve dans l'infrarouge, où la dilution permet de faire apparaître un pic pour la fonction -OH libre.
