Dosage par spectroscopie UV-visible
Corrigé du concours assistant ingénieur Lille 2005 : dosage par spectroscopie UV
1) L'absorbance est définie telle que A = - log T avec T la transmittance.
T = I/I0 d'où A = -logI/I0 avec I0 l'intensité du faisceau incident, et I l'intensité du faisceau transmis.
Loi de beer-lambert: l'absorbance d'une solution de concentration c placée dans une cuve de longueur l à une longueur d'onde donnée est définie telle que A = el c.
2) C = 10-5 mol/l, A= 0.02, l =1cm d'où e= A/l c = 0.02/(10-5*1)= 2000 l/mol.cm
Concentration maximale pour A = 2:
C = A/ el = 2/2000x1 = 0.001 mol/L. C'est une concentration très faible.
3) L'absorption dans le domaine UV-visible a pour origine l'absorption de photons par les électrons de la couche externe de la molécule. Dans le domaine UV-visible utilisé en spectroscopie (190 nm - 1100 nm), les transitions observées sont:
Transition n![]() σ*: passage d'un électron d'un doublet à une orbitale moléculaire (OM) σ* anti-liante
σ*: passage d'un électron d'un doublet à une orbitale moléculaire (OM) σ* anti-liante
Transition n![]() π*: passage d'un électron d'un doublet à une orbitale moléculaire π*anti-liante:
π*: passage d'un électron d'un doublet à une orbitale moléculaire π*anti-liante:
Transition π![]() π*: passage d'un électron d'une OM liante π à une orbitale moléculaire π*anti-liante
π*: passage d'un électron d'une OM liante π à une orbitale moléculaire π*anti-liante
Transition d![]() d: concerne les métaux de transitions avec des orbitales d
d: concerne les métaux de transitions avec des orbitales d
4) Le groupement nitro est attracteur par effet mésomère et va accentuer le déficit électronique sur l'atome d'oxygène. Le p-nitrophénol est donc plus acide que le phénol.
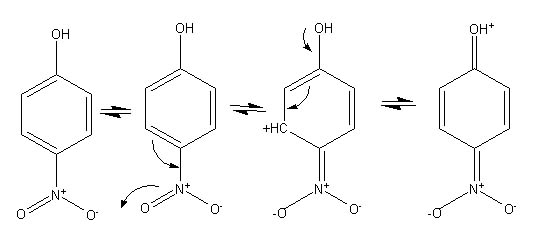
5) Le pKa étant élevé, l'acide est très faible. L'amplitude du saut de pH est donc limitée.
6) Ka= [A-][H+]/[AH]
Pka = -logKa et pH = -log[H+]
D'où pH= Pka + log [A-]/[AH]. La relation montre qu'il faut avoir [A-] = [AH] pour avoir pH= Pka.
7) L'absorbance à 390 nm augmente tandis que celle à 310 nm diminue avec l'addition de soude.
p-nitrophénol + NaOH ![]() p-nitrophénolate de sodium + H2O
p-nitrophénolate de sodium + H2O
La concentration et donc l'absorbance de la base conjuguée du p-nitrophénol augmente en cours du dosage. Le pic correspondant est celui à 390 nm. L'absorption à 310 nm correspond au p-nitrophénol.
8) Les courbes d'absorption résultent de l'addition du p-nitrophénol et du p-nitrophénolate. Le point isobestique est le point d'intersection entre ces 2 courbes.
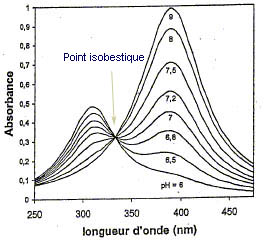
L'absorbance totale en tout point de la courbe est A = eAHl cAH + eA-l cA-
à ce point est A = eisol (cAH + cA-).
Avec eiso = eAH = eA-
La relation devient A = eiso l cAH + eiso l cA-
Soit A = eiso l (cAH +cA-)
L'absorbance reste constante quelque soit les proportions en p-nitrophénol et p-nitrophénolate.