Dosage par spectroscopie UV-visible
Enoncé concours assistant ingénieur Lille 2005 : dosage par spectroscopie UV
Les indicateurs colorées acido-basiques, appelés aussi molécules sondes de pH, sont des molécules dont les propriétés spectroscopiques, en général l'absorption dans l'UV-visible, dépend du pH de la solution. Elles présentent l'avantage d'être efficaces à des concentrations très faibles. Cette technique est l'une des rares permettant une mesure de pH dans des volumes inférieurs au mm3 et allant jusqu'au mm3.
Dans toute la suite la largeur de la cuve est l = 1 cm et le solvant est l'eau.
Une solution de colorant de concentration C, absorbant à une longueur d'onde l avec un coefficient d'absorption molaire e, est placé dans une cuve de longueur l à l'intérieur d'un spectromètre UV-visible. A partir du rapport de l'intensité mesurée I sur l'intensité initiale I0, on peut déduire l'absorbance A ou densité optique.
1) Quelle relation existe-t-il entre I, I0 et A ? Rappeler la loi de Beer-Lambert.
2) Une solution de concentration C=1.10-5 mol/L présente une absorbance de 0,02 dans une cuve de trajet optique de 1 cm. Quel est le coefficient d'absorption molaire e de la molécule? Quel est son unité ?
Sachant qu'il n'est pas possible de mesurer des absorbances supérieures à 2, quelle est la concentration maximale que l'on puisse mesurer ? Commenter cette valeur.
3) Les dérivés du phénol sont utilisés comme sonde de pH grâce à leurs propriétés spectroscopiques et acido-basiques. Quelle(s) caractéristique(s) possède(nt) les molécules qui présentent une bande d'absorption dans l'UV-visible ?
Le p-nitrophénol est un acide faible. Son pKa, voisin de 7, peut être déterminé par dosage pH-métrique et par dosage spectrophotométrique. La figure ci-dessous (figure 1) montre la courbe de titrage ( courbe a) de 10 mL d'une solution de p-nitrophénol de concentration 1.10-4 mol/L par la soude 1.10-2 mol/L.
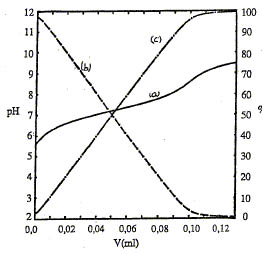 FIGURE 1
FIGURE 1
Les courbes de répartition (courbes b et c) des deux formes acide-base conjuguée, obtenues par simulation, sont également représentées ( pourcentages rapportés à l'échelle de droite)
4) Le p-nitrophénol est-t-il un acide plus fort ou plus faible que le phénol ? Justifier.
5) Comment expliquez-vous la très faible amplitude du saut de pH autour du point d'équivalence ?
6) Quelles sont les conditions, satisfaites ici, faisant que l'on ait pH=pKa à la demi-équivalence ?
Le titrage précédent est suivi par spectrométrie UV-visible. On obtient les courbes de la figure ci-dessous (Figure 2):
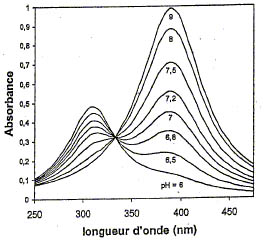
7) Les longueurs d'onde des deux maximums observés sur la figure 2 sont respectivement 310 nm et 390 nm. Identifier les deux formes du p-nitrophénol correspondantes.
8) Lorsque, à une longueur d'onde liso les deux espèces ont le même coefficient d'absorption molaire eiso on observe sur les différents spectres un point particulier appelé point isobestique. Identifier ce point sur la figure. Justifier votre réponse.