Calcul du nombre de mole
Définition du nombre de moles
Le nombre de moles est obtenu par la relation:
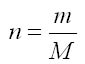
avec:
n: le nombre de mole en mole.
m: la masse de l'échantillon en g
M: la masse molaire en g/mol
Calcul pour un solide
Il suffit d'appliquer la relation n=m/M pour déterminer le nombre de mole.
Exemple: Calculer le nombre de moles contenues dans 10 g de NaCl.
Avec MNaCl = 58,5 g/mol
nNaCl = 10/58.5 = 0,17 mole
Calcul pour un liquide
Dans ce cas, l'on dispose généralement d'un volume. Il faut donc tenir compte de la masse volumique du liquide et éventuellement de sa teneur. La relation devient:
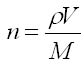 avec
avec
ρ: la masse volumique en g/mL
V: le volume en mL
Exemple: Calculer le nombre de mole dans 1 litre d'éthanol.
Avec MC2H6O = 46,07 g/mol et ρC2H6O= 0,89 g/mL
Correction
n = 0,89x1000/46,07= 19,31 mole
Calculer le nombre de mole dans 0,1L d'acide sulfurique à 33% (On donne d = 1,84 et M = 98g/mol)
Correction
n = 1,84x100x0,33/98 = 0,61 mole
D'autres exercices sur les nombres de mole

