Nomenclature et propriétés des alcanes
Les alcanes sont des hydrocarbures qui ne contiennent que des atomes de carbone et d'hydrogène reliés par des liaisons simples. Ils peuvent être linéaires ou ramifiés.
Le suffixe correspondant aux alcanes est -ane.
Détermination du nom des alcanes
- Chercher la chaîne carbonée la plus longue
- Le cas échant (si présence de 2 chaînes de même longueur) prendre la plus substituée
- Prendre les indices de positions les plus petits possibles
Exemple:
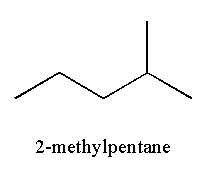
2-methylpentane
2,4,6-trimethyloctane
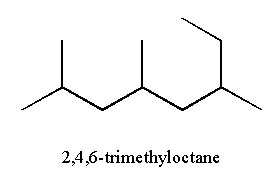
Remarque: il suffit de numéroter les atomes de carbones pour déterminer les indices sur lesquels sont accrochés les radicaux.
Cas des alcanes cycliques:
On place le préfixe «cyclo» devant le nom de l'alcane:
Exemple: cyclohexane.
Liste des préfixes des alcanes aliphatiques en fonction du nombre de carbone
n = 1: méthane
n = 2: éthane
n = 3: propane
n = 4: butane
n = 5: pentane
n = 6: hexane
n = 7: heptane
n = 8: octane
n = 9: nonane
n = 10: décane
n = 11: undécane
n = 12: dodécane
Remarque : Le nom est souvent précédé de la lettre 'n' pour les alcanes linéaires. On parlera donc indifférement d'hexane ou de n-hexane.
La formule générale des alcanes étant Cn H2n+2, il est facile de calculer le nombre d'hydrogène.
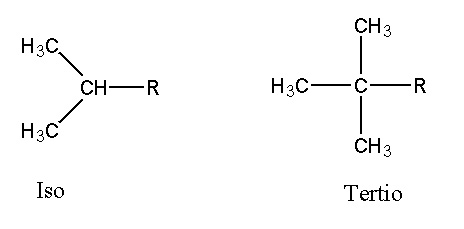
Préfixe iso et tertio
Dans le cas des molécules ramifiées, les préfixes iso ou tertio peuvent être employés.
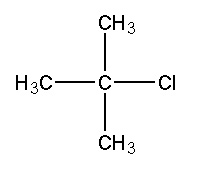
C'est pouquoi la molécule ci-dessous, le 2-chloro-2-méthylpropane (nom selon la norme IUPAC) est fréquemment appelée " chlorure de tertiobutyle".
Propriétés des alcanes
Les hydrocarbures sont apolaires et insolubles dans l'eau. Ils ont miscibles dans de nombreux solvants organiques comme l'éther diéthylique ou l'éthanol. Ils ont assez peu réactifs.
Leur température de fusion et d'ébullition augmente avec la longueur de la chaine carbonnée. A la température ambiante, le methane, l'éthane, le propane et le butane sont gazeux. Du pentane à l'hexadecane, ils se presentent sous forme de liquide. Au delà de 15 atomes de carbones, ce sont des solides.
Pour un même nombre de carbone, l'alcane ramifié présente des températures de changement d'état légèrement inférieures à son homologue linéraire.