Chaîne électrolytique
La chaîne électrolytique est composé de 2 demi-cellules et peut être représentée comme ci-dessous :
Electrode de référence | Jonction électrolytique | Electrolyte | Electrode indicatrice
La tension aux bornes de la cellule est égal à :
E = Eind – Eref + Ej
En pratique, on utilise un pont électrolytique (pont salin) et le terme Ej est négligé car sa valeur est généralement de l'ordre de quelques millivolts.
Le potentiel d'électrode
Lorsque l'on plonge un conducteur métallique, une électrode inattaquable (comme le platine par exemple), dans un électrolyte contenant un couple redox, il se produit spontanément un échange d'électrons entre l'électrolyte et les électrons de surface de l'électrode jusqu'à l’équilibre. Cette distribution hétérogène des charges est à l'origine de la tension galvanique ou tension d'électrode. Cette zone s'appelle la "double couche électronique". Elle est représentée par le schéma ci-dessous.
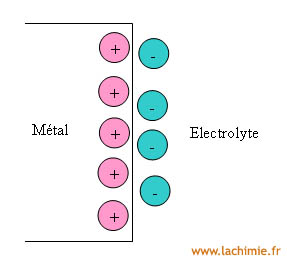
Cette tension n'étant pas directement mesurable, il est nécessaire de prendre une autre demi-cellule afin de mesurer une différence de potentiel à l'aide d'un voltmètre. En pratique, on utilise une électrode en référence dont le potentiel ne varie pas.
Remarque : la borne négative du voltmètre est relié par convention à l'électrode de référence.
Potentiel de jonction liquide (Ej)
Des différences de potentiel se créent à chacune des interfaces de la chaîne électrolytique. C'est donc le cas à l'interface entre 2 liquides de compositions différentes. Son origine est due à la différence de mobilité à travers la membrane poreuse des anions et des cations. Il en résulte une répartition inégale des charges créant un potentiel de jonction.
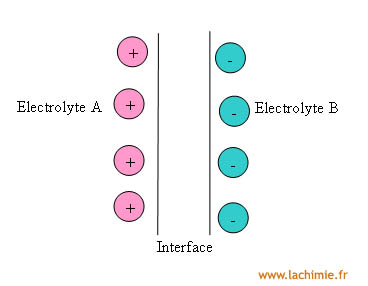
Afin de minimiser son importance, on utilise un pont électrolytique (pont salin), le plus souvent une solution de KNO3 à 1 mol/L.