Dosage de l'eau oxygénée H2O2 par la permanganate de potassium
L'eau oxygénée de formule H2O2 est commercialisée à différentes concentrations, le plus souvent à 6 ou 30% en masse. Elle se dismute lentement au cours de temps selon la réaction ci-dessous, ce qui nécessite de contrôler régulièrement sa concentration.
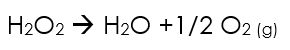
La décomposition est accélérée par la chaleur et la lumière. Elle sera donc préférentiellement stockée au frais dans des emballages opaques.
Ses propriétés oxydantes peuvent être utilisées pour réaliser son dosage. Le plus courant est de la doser par le permanganate de potassium, préalablement étalonné avec une solution de sel de Mohr.
Le potentiel standard E° du couple O2/H2O2 a pour valeur : E° O2/H2O2 = 0.69 V.
Le potentiel standard E° du couple MnO4-/Mn2+ a pour valeur : E° MnO4-/Mn2+O2 = 1,51 V
Equation bilan de la réaction de dosage :
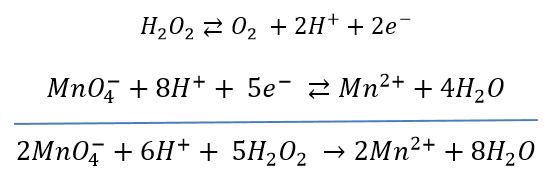
Conditions opératoires
La concentration d'une solution d'H2O2 à 30 % ( masse volumique 1,1 g/cm3 et masse molaire 34 g/mol) est de 9,79 mol/L. La solution est diluée 100 fois avant d'être dosée par le permanganate de potassium à 4.10-2 mol/L. la solution est acidifié par 2 mL d'H2SO4 à 2 mol/L. Le KMnO4 est placé dans une burette de 25 mL tandis que l'eau oxygénée et l'acide sulfurique sont versés dans un bécher de 100 mL. Le point équivalent est obtenu au passage de la solution incolore à la couleur violette. Le volume attendu est de l'ordre de 10 mL.
Dosage par colorimétrie
Principe du dosage: l'iodure de potassium est oxydé en diiode par l'eau oxygénée. La couleur brune du diiode formé permet de tracer une droite d'étalonnage en fonction de la concentration en H2O2. Cette réaction est lente, ce qui peut également faire l'objet d'une étude cinétique. En raison de cette faible vitesse de réaction, les conditions opératoires devront être scrupuleusement contrôlées. Les mesures seront effectuées à un temps identique pour toutes les solutions étalons et échantillons. L'autre facteur cinétique à contrôler est la température. La solution la plus simple pour avoir une température constante et reproductible consiste à placer les fioles dans un bain d'eau glacée en attendant que I2 se forme.
Le potentiel standard E° du couple H2O2/H2O a pour valeur : E° H2O2/H2O = 1,77 V, celui du couple I2/I- vaut 0,53 V
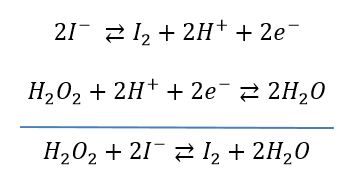
Dans l'exemple ci-dessous, la solution d'H2O2 à 30 % à été dilué 20 fois (500 µL dans 10 mL) - Le spectrophotomètre utilisé est un Shimadzu UV-2600. Les solutions ont été préparées dans des fioles de 10 mL puis ont été placées 30 minutes dans la glace avant d'effectuer la mesure.
| Etalon | H2O2 dilué | KI à 0,1 M | H2SO4 à 2 M |
| 1 | 20 µL | 1 mL | 25 µL |
| 2 | 40 µL | 1 mL | 25 µL |
| 3 | 60 µL | 1 mL | 25 µL |
| 4 | 80 µL | 1 mL | 25 µL |
| 5 | 100 µL | 1 mL | 25 µL |

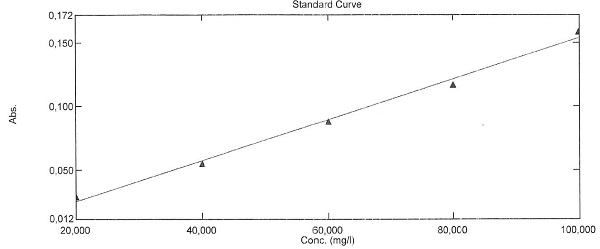
On obtient une droite avec un coefficient de détermination R² de 0.992, une valeur correcte pour effectuer du contrôle de routine sur la concentration de l'eau oxygénée.