La pile Daniell
La plus connue est la pile Daniell constituée des couples Zn2+/Zn et Cu2+/Cu.
Fonctionnement d'une pile Daniell
D’après les potentiels respectifs de chaque couple rédox : E°Cu2+/Cu = 0.34 V et E°Zn2+/Zn = - 0.76 V, il va y avoir oxydation du zinc (dissolution du zinc métallique) et dépôt de cuivre.
Cu2+ + 2e- ⇌ Cu
Zn ⇌ Zn2+ + 2e-
_______________
Cu2+ + Zn ![]() Cu + Zn2+
Cu + Zn2+
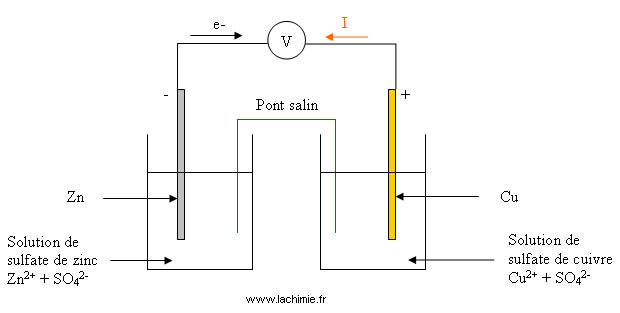
D’après les potentiels standards, le zinc va s’oxyder : la plaque de Zn sera donc l’anode. Le Cuivre va se réduire (dépôt de cuivre), la plaque de cuivre sera la cathode.
Les potentiels dans chacune des demi-piles s'écrivent (équation de Nernst)
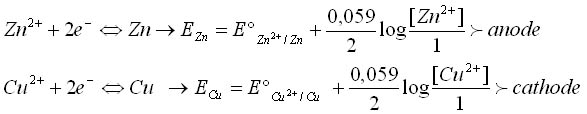
Par convention, une pile est représenté comme ci-dessous:
Zn2+|Zn || Cu2+|Cu
Le pôle + est toujours placé à droite et le pôle - à gauche
Application numérique:
[Cu2+] = 0.1 mol/
[Zn2+] = 0.1 mol/L
E°Cu2+/Cu = 0.34 V
E°Zn2+/Zn = - 0.76 V
On obtient: E = 1.1 V
Remarque: Le pont salin permet le passage des ions pour conserver l'électroneutralité.
