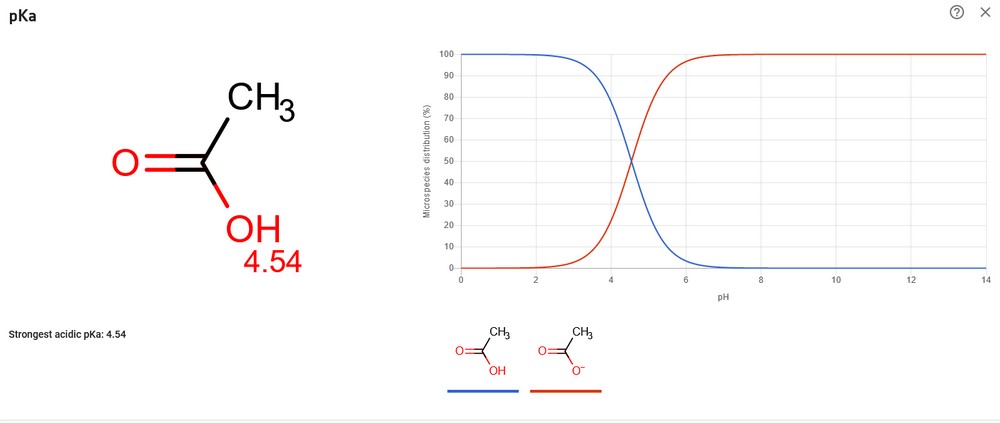
Définition du pH, du Ka et du Pka
Définition du pH
Le pH est définit par la relation :
L'autoprotolyse de l'eau correspond à l'équilibre suivant :
H2O + H2O ↔ H3O+ + OH-
La constante d'équilibre s'écrit Ke = [OH-][H+]/1 = [OH-][H+]
Cette constante d'équilibre, dépendante de la température, est également appelée produit ionique de l'eau. Il est égal à :
Pour l'eau pure on a : [OH-] = [H+] = 10-7 mol/L. Le pH vaut donc 7.
Dans le cas des acides faibles, on définit la constante d'équilibre de dissociation de l'acide ou constante d'acidité.
AH + H2O ![]() A- + H3O+
A- + H3O+
Elle est notée Ka et s'écrit :

Définition du pKa
A partir du Ka on définit le pKa qui s'écrit
On utilise généralement le Pka plutôt que le Ka pour déterminer la force d'un acide.
On remarque que plus l'acide est fort plus le pKa est petit. En effet, si celui est fortement
dissocié, la concentration [AH] devient faible.
La relation devient en introduisant les logarithmes dans la relation du Ka :
-log [Ka] = - log [H+] - log[A-]/[AH] → pKa = pH - log[A-]/[AH]
d'où la définition du pH en fonction du pKa :
Des difficultés avec le pH ? Accédez au calcul automatisé en indiquant la concentration de l'acide ou de la base et selon les cas le pKa.
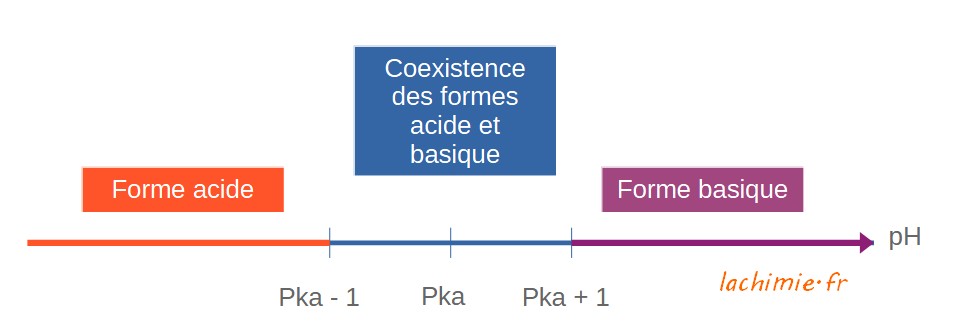
Domaine de prédomimance
A partir de la relation du pH en fonction du pKa, l'on peut déduire les formes dominantes des acides et des bases en solution en fonction du pH.
Lorsque le pH est égal au pKa, les concentrations [AH] et [A-] sont égales (log 1 = 0).
A un pH inférieur au pKa, la forme acide AH est majoritaire et à un pH supérieur, c'est la forme basique qui devient majoritaire.