Quotient de réaction
Définition du quotient de réaction
Soit une réaction: αA + βB → γC + δD
Le quotient de réaction s'écrit:
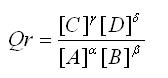
Les concentrations [A], [B], [C], [D]... sont en mol/L.
Les solides et l'eau prennent pour valeur C0= 1 mol/L.
A noter qu'en toute rigueur il faudrait utiliser l'activité à la place des concentrations.
Pour les gaz, l'activité est dans le cas d'un gaz parfait égale au rapport de la pression partielle sur la pression standard égale à 1 bar.
La relation simplifiée du quotient de réaction s'écrit :
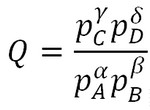
Il sera ensuite judicieux d'utiliser la pression totale et les fractions molaires de chaque constituant
Exemple :
Quotient de réaction de précipitation d'AgCl
Ag+ + Cl- → AgCl (solide)
Qr = 1/[Ag+][Cl-]
Lorsque le système atteint son état d'équilibre, le quotient de réaction devient une constante d'équilibre notée K = Qr.
Si les valeurs de K sont supérieures à 104, on considère que la réaction est totale. Inférieure à 10-4, la réaction est très faible (quasiment pas de formation de produits). Entre les deux, la transformation est dîte limitée.
