La loi de Beer-Lambert et son domaine de validité
Définition de la loi de Beer-lambert
Soit une radiation monochromatique de longueur d'onde fixe traversant un échantillon d'épaisseur l, l'absorbance vérifie la loi de beer-lambert soit :
Avec :
- A : absorbance
- ε: le coefficient d'absorption molaire en L.mol-1.cm-1
- l : la largeur de cuve en cm
- c : la concentration de la solution en mol/L
Applications de la loi de beer-lambert
Cette loi est utilisée pour de nombreux dosages d'espèces chimiques colorées. Pour des composés incolores, il est parfois possible de fabriquer des complexes colorés.
Cette loi n'est valable que pour les faibles concentrations et en général pour des absorbances inférieures à 1. Toutefois, ceci va dépendre du soluté étudié et de la qualité du spectrophotomètre. Les appareils les plus récents acceptent des absorbances beaucoup plus élevées.
Dans tous les cas pour s'assurer que la loi est vérifiée dans le domaine d'étude choisi, il suffit de tracer l'absorbance en fonction de la concentration. La loi de Beer-Lambert est applicable dans la partie rectiligne du tracé.
Au-delà d'une certaine concentration, la linéarité n'est plus obtenue comme le montre l'analyse spectrophotométrique ci-dessous.
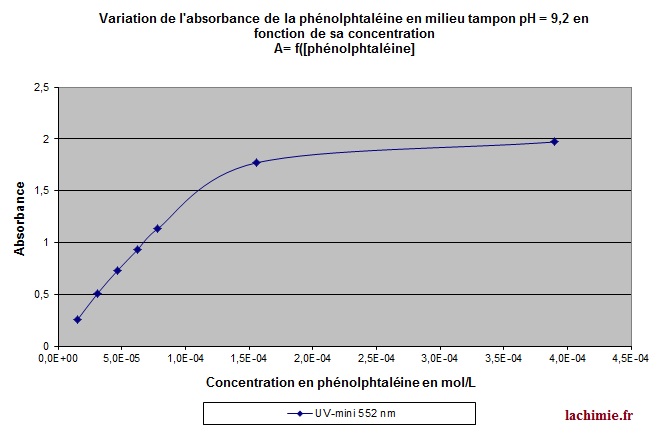
Il est donc parfois nécessaire de réaliser des dilutions pour rester dans le domaine linéaire. La loi de beer lambert est également utilisée dans certains détecteurs comme ceux installés en HPLC.