Force éluante de la phase mobile en HPLC et isoéluance
Elle est notée ε0 et permet de classer les solvants en HPLC suivant leur force éluante : ce sont les séries éluotropiques. Ces données sont très importantes car elles permettent de prévoir l'ordre de sortie des composés en chromatographie. Elles dépendent de la polarité de la phase stationnaire.
Série éluotropique sur l'alumine (adsorbant polaire)
| Eluant | ε0 |
|---|---|
| n-pentane | 0 |
| n-heptane | 0,01 |
| CCl4 | 0,18 |
| Benzène | 0,32 |
| Ether éthylique | 0,38 |
| CHCl3 | 0,4 |
| Dichlorométhane | 0,49 |
| Acétone | 0,56 |
| Acétate d'éthyle | 0,58 |
| Pyridine | 0,71 |
| Propanol | 0,82 |
| Ethanol | 0,88 |
| Méthanol | 0,93 |
| Acide acétique | >1 |
Série éluotropique pour adsorbants non polaires
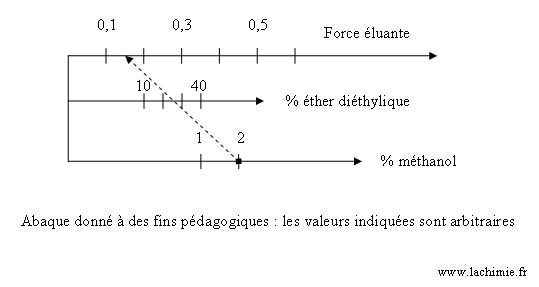
Abaques de force éluante
Des abaques permettent de déterminer la force éluante ε0 d'un mélange de solvants. L'abaque ci-dessous permet de déterminer la force éluante un mélange d'hexane additionné d'éther diéthylique et de méthanol.
 Les solvants utilisés en HPLC étant le plus souvent des couples eau/acétonitrile ou eau/méthanol et il peut s'avérer fort utile de passer de l'un à l'autre sans utiliser d'abaque. Des proportions d'isoéluance ont été établies, permettant une conversion aisée :
Les solvants utilisés en HPLC étant le plus souvent des couples eau/acétonitrile ou eau/méthanol et il peut s'avérer fort utile de passer de l'un à l'autre sans utiliser d'abaque. Des proportions d'isoéluance ont été établies, permettant une conversion aisée :
Proportion d''isoéluance: %Acétonitrile = 0,78 %Méthanol
Il suffit donc de multiplier le % de méthanol par 0,78 pour le remplacer par de l'acétonitrile (Il faut donc plus d'eau).
Exemple :
La phase eau/méthanol 30/70 aura comme équivalent la phase eau/acétonitrile 45,4/54,6
Inversement on a: %Méthanol = 1,28 %Acétonitrile
A noter dans le cas du tétrahydrofuranne (THF), la relation d'isoéluance est %THF = 0,62 %Méthanol.