La phase mobile en HPLC: comment la déterminer ?
Guide de choix de la phase mobile
Si la phase stationnaire (colonne) est polaire, on utilise un solvant peu à pas polaire (phase mobile). C'est la chromatographie en phase normale
Si la phase stationnaire (colonne) est apolaire ou peu, on utilise un solvant polaire. C'est la chromatographie en phase inversée.
Les solvants d'HPLC sont donc classés suivant leur polarité et leur force éluante.
En faisant varier la composition du solvant, on fait varier le coefficient de distribution K et donc le pouvoir d'élution.
Les solvants doivent être miscibles et ne pas gêner la détection (absorption UV par exemple).
Coefficient de distribution K
Le coefficient de distribution est définit par la relation
Avec Cs la concentration du soluté dans la phase stationnaire
Avec Cm la concentration du soluté dans la phase mobile
Détermination optimale des proportions optimales de la phase mobile
Dans le cas des colonnes en phase inverse, on utilise le plus souvent un couple de solvant eau/ acétonitrile ou eau/méthanol. L'acétonitrile, bien que plus coûteux permet d'obtenir généralement une meilleure efficacité.
Le facteur de rétention k (Attention à ne pas confondre avec K le coefficient de distribution) est proportionnel au pourcentage en eau de la phase mobile et la fonction log k = f(%eau) est linéaire. Une élution optimale s'effectuera pour des valeurs de k comprises entre 2 et 10.
L'optimisation consiste à réaliser plusieurs injections d'une solution contenant les composés à éluer en faisant varier le %eau dans la phase mobile
Il suffit ensuite de tracer logk =f(%eau) pour déterminer les conditions idéales d'élution : c'est la modélisation D'Everett.
Exemple d'élution d'un mélange de 3 composés A,B et C dont on fait varier les proportions de la phase mobile eau/acétonitrile à chaque injection:
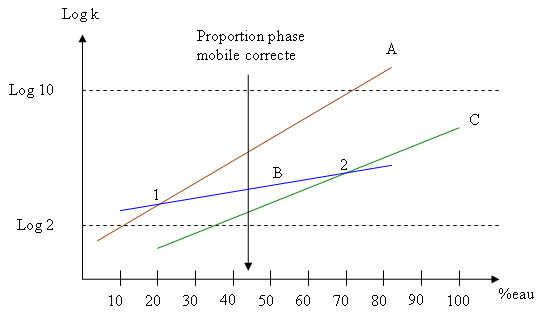
- pour une phase mobile eau/acétonitrile à 20/80, les composés A et B ne sont pas séparés (point 1)
- pour une phase mobile eau/acétonitrile à 70/30, les composés B et C ne sont pas séparés (point 2).
La meilleure proportion eau/acétonitrile est donc de l'ordre de 44/56.
A noter que dans le cas où les droites des composés ne coexistent pas entre log10 et log2 ( impossible de couper les 3 droites avec la droite verticale de proportion de phase correcte), il faut effectuer une élution avec un gradient de solvant ou changer de colonne !
Les conditions d'élution avec un mélange binaire ne permettent pas toujours d'obtenir des résultats satisfaisants (droite A et C très proche l'une de l'autre par exemple). Il faut alors faire appel à un mélange ternaire. Pour déterminer les proportions idéales de ce mélange, la technique consiste à effectuer 2 élutions avec 2 phases mobiles ayant la même force éluante (consultez la fiche sur les forces éluantes).
Exemple : prenons l'élution de 3 composé A,B,C.
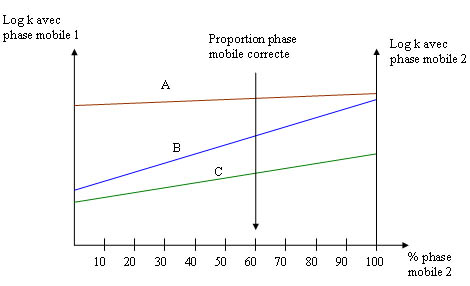
Avec la phase mobile 1 de composition eau/méthanol, les composés A et B sont mal séparés, avec la phase mobile 2, ce sont les composés A et B qui se séparent mal.
La phase mobile optimale sera donc un mélange à 60% de phase mobile 2 et 40% de phase mobile 1.
Tampons usuels d'HPLC
Il est fréquent de devoir fixer le pH de la phase mobile. On utilise pour cela des solutions tamponnées à la place de l'eau. Elles sont préparées à partir d'acides, de bases ou de sels.
| Composé | PKa | Plage de tampon | Compatibilité LC/MS |
|---|---|---|---|
| Acide trifluoroacétique à 0,1% | 0,3 | 1,8 | Oui |
| Phosphate | 2,1 | 1,1 à 1,3 | Non |
| Citrate | 3,1 | 2,1 à 4,1 | Non |
| Acide formique à 0,1% | 2,8 | 2,7 | Oui |
| Citrate | 4,7 | 3,7 à 5,7 | Non |
| Acide acétique à 0,1% | 4,8 | 3,3 | Oui |
| Citrate | 6,4 | 4,4 à 6,4 | Non |
| Phosphate | 7,2 | 6,2 à 8,2 | Non |
| Ammoniaque 25% à 0,1% | 9,2 | 8,8 | Oui |
| Phosphate | 12,3 | 11,3 à 13,3 | Non |
Polarité des produits chimiques
La polarité des composés organiques organique peut être classéedu moins polaire au plus polaire :
1) hydrocarbures
2) amine tertiaires
3) aldéhydes et cétones
4) alcools
5) acides
6) phénols
7) amines secondaires
8) les acides hydroxylés
9) amines primaires
A noter que les alcools, phénols et acides ont quasiment la même polarité. Ce classement est un première approche. Pour déterminer quelles seront les meilleures conditions d'élution, la première chose à regarder sera le logP du composé.