Acide orthophosphorique
Préparation et dosage d'une solution aqueuse d'acide orthophosphorique.
Préparation d'une solution décimolaire d'acide orthophosphorique à partir d'une solution commerciale.
Un flacon d'acide orthophosphorique commercial porte les indications suivantes : H3PO4 : 98 g/mol ; pourcentage en masse : 85 % ; densité d = 1,69.
1) Calculer la concentration molaire de la solution commerciale en H3PO4.
2) A partir de cette solution, comment opérez-vous pour préparer une solution d'acide orthophosphorique de 0,1 mol/L? Vous disposez pour cela de la verrerie classique (pipette, burette, fiole jaugée, erlenmeyer, bécher, éprouvette graduée...). Vous donnez les raisons pour lesquelles vous utilisez telle ou telle verrerie de préférence à une autre.
3) Quelle(s) précaution(s) faut-il prendre lors de la préparation de la solution ? En cas de projection d'acide sur la main, que faites vous ?
Dosage de la solution d'acide orthophosphorique préparée :
Le but de ce dosage est de déterminer de façon précise la concentration de la solution précédemment préparée.
Le dosage est réalisé en traçant la courbe de neutralisation de 50 mL de la solution d'acide par une solution titrée d'hydroxyde de sodium à 1 mol/L. Le pH de la solution est mesuré à l'aide d'un pHmètre.
1) Vous disposez d'électrode de verre, de platine, d'argent, au calomel et au sulfate mercureux. Laquelle ( lesquelles) choisissez-vous ? Justifier votre choix, en expliquant leur(s) rôle(s).
2) Doit-on effectuer un étalonnage particulier ? Si oui, lequel ?
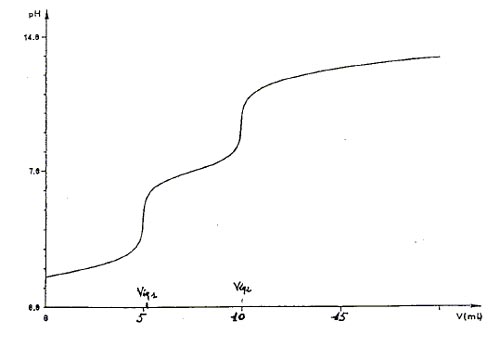
3) La courbe, représentant la variation du pH en fonction du volume V (en mL) de soude est donnée ci-jointe.
a) Expliquer les diverses parties de cette courbe de dosage.
b) Les valeurs des pKa de H3PO4 sont; pKa1 = 2,2 et pKa3 = 12,3. Donner la valeur de pKa2 à partir du graphe.
4)a)Quel volume équivalent choisir pour déterminer la concentration de l'a solution? Expliquer.
b)Veq1 = 5,05 mL et Veq2 = 10 mL. Calculer la concentration exacte de la solution d'acide orthophosphorique.
5) On ne peut pas doser la troisième acidité, car elle est trop faible. Néanmoins, on sait préparer des phosphates trisodiques... en solution concentrée ou par voie sèche.
a) Quelle réaction chimique se produit lorsqu'on met en solution dans l'eau du phosphate trisodique?
b) Calculer le pH d'une solution décimolaire de phosphate trisodique