Liaison chimique : la liaison covalente
La formation d'une liaison covalente est due au recouvrement d'orbitale de 2 atomes
Pour simplifier, on peut également définir la liaison covalente simple comme la mise en commun de 2 électrons par 2 atomes. Chacun des atomes fournissant un électron. Seuls les électrons de la couche externe interviennent.
Exemple: la molécule de dichlore Cl2
L'atome de chlore comprend 17 électrons avec comme configuration électronique:
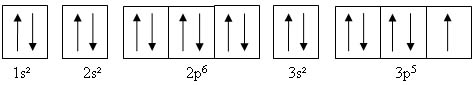
La dernière case quantique ne contient qu'un seul électron. La mise en commun de cet électron avec un autre atome de chlore va permettre la formation d'une liaison chimique covalente.

En considérant uniquement les électrons de couche externe, on peut schématiser cette mise en commun à l'aide des cases quantiques.
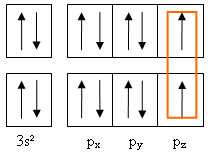
Les orbitales px et py contiennent 2 électrons. La liaison se forme par recouvrement axial de l'orbitale pz
Liaisons chimiques covalentes: remarques importantes
- Le recouvrement axial d'orbitale conduit à la formation de liaisons covalentes simples σ
- Le recouvrement latéral d'orbitale conduit à la formation de liaisons π formant des doubles ou triples liaisons.
- La résolution de l'équation Schrödinger mène également à l'existence d'orbitale anti-liante dont l'énergie est supérieure à celle de l'orbitale moléculaire liante
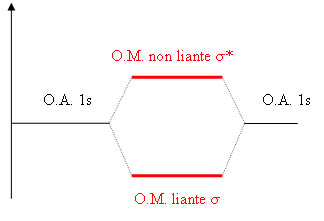
Diagramme énergétique de la molécule de H2
La formation de la liaison s'effectue par recouvrement des 2 orbitales atomiques (OA) 1s de l'atome d'hydrogène pour former des orbitales moléculaires (OM) liante et anti-liante.
Force de la liaison covalente
C'est l'énergie qu'il faut fournir pour briser la liaison.
Elle est exprimée en kcal/mol
Liaison C - C → E = 83 kcal/mol
Liaison C - H → E = 100 kcal/mol
Liaison H - H → E = 104 kcal/mol
Liaison O - H → E = 110 kcal/mol
Longueur de liaison
Elles est de l'ordre de Å (Amstrong)
H - H environ 0,75 Å
C - H environ 1,1 Å
N - H environ 1,01 Å