Conductivité des électrolytes
L'intérêt de la conductimétrie est de pouvoir comparer la conductivité de différentes solutions. On définit donc la conductivité par unité de concentration ou conductivité molaire.
Conductivité molaire d'un ion
Soit un ion i, elle est notée
λi = la conductivité molaire en Sm²/mol
|zi| = la charge en valeur absolue de l'ion i
ui: sa mobilité en m²/s.V
F: la constante de faraday en C/mol
Si la concentration de l'ion i → 0, λi devient λi°, la conductivité molaire à concentration nulle également appelée conductivité molaire limite.
Conductivité ionique molaire d'une solution
Dans une solution, chaque ion contribue à la conductivité proportionnellement à sa concentration.
La conductivité ionique molaire s'écrit:
σ: la conductivité ionique molaire en s/m
λi: la conductivité molaire de l'ion en S.m²/mol
ci: la concentration en mol/m3
Conductivité molaire d'un électrolyte
On définit la conductivité molaire d'un électrolyte le rapport de conductivité ionique et sa concentration. C'est la loi de Kohlrausch et elle s'écrit:
Cas des électrolytes forts
Les électrolytes sont considérés comme forts lorsque leur dissociation est complète α=1.
Dans ce cas de figure, on peut démontrer la relation:
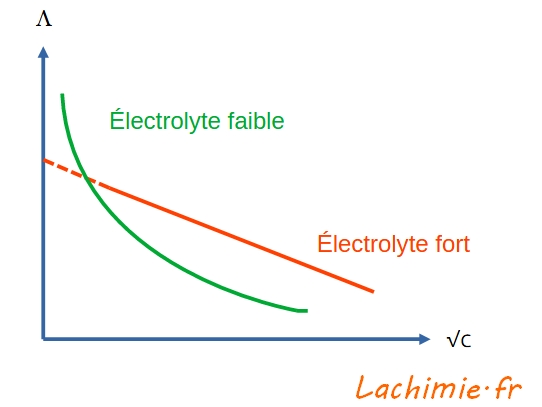
Λ = Λ° - k√c
On peut par la suite déterminer par extrapolation la conductivité molaire limite Λ° en traçant Λ en fonction de √c.
La pente de cette droite permet de déterminer la valeur de la constante k.
Cas des électrolytes faibles
Dans ce cas, la variation de Λ n'est plus linéaire en fonction √c mais prend une allure hyperbolique. Il n'est plus possible de déterminer Λ° par extrapolation.
| CH3COOH | + H2O | → | CH3COO- | + H3O+ | |
| A t = 0 | C0 | 0 | 10-7 | ||
| A t final | (1-α)C0 | αC0 | ~αC0 |
Dans le cas d'une solution suffisamment diluée, il est possible d'écrire la relation suivante :
Λ = α(λ+ + λ-) = α(λ°+ + λ°-) = αΛ°
