Définition de la Loi de Faraday
Définition : La production d’une réaction électrochimique obéit à une loi quantitative, dite loi de Faraday (1834), reliant les quantités (nombres de moles) des substances électroactives transformées (consommées ou produites) à une électrode El à la charge électrique totale ayant été transférée pour cela à travers l’interface El/sol.
Q est la quantité d'électricité exprimée en coulomb.
L'électron a une charge de e = 1,6 x 10-19 C.
Constante de Faraday : F = 96480 C.mol-1 - C'est la charge d'1 mole d'ion (1,6 x 10-19 x 6,022 x 1023 = 96480 C)
Prenons le cas d'une réaction de la réduction d'un ion métallique
![]()
Pou N moles de Mn+, la quantité d'électricité s'écrit :
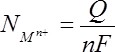
C'est la seconde loi de Faraday.
Dans le cas général d'une demi-réaction d'oxydo-réduction
![]()
La quantité de courant échangée est avec N le nombre de moles d'électrons :
![]()
D'où la relation générale :
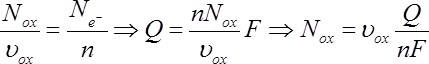
Courant électrique
Le courant électrique est une variation de charge en fonction du temps.
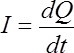
L'unité de l'intensité est l'ampère équivalent à des C.s-1
1 coulomb (C) est par définition, la quantité d'électricité transporté en 1 seconde par un courant de 1 ampère.
La relation est connue pour être la première loi de Faraday.