Dosage de l'acide chlorhydrique par mesure de la conductivité
L'intérêt de cette manipulation est de déterminer la concentration molaire d'une solution diluée d'acide chlorhydrique HCl en utilisant un conductimètre. Une solution de soude NaOH est utilisée comme titrant.
C'est un dosage acide fort - base forte. La réaction est totale et s'écrit :
HCl + NaOH → Na+ + Cl- +H2O
Principe du titrage
Un volume VA de 10 mL d'acide chlorhydrique de concentration inconnue CA est prélevé à l'aide d'une pipette jaugée munie d'une propipette et versé dans un bécher de 400 mL. Un volume de 200 mL d'eau est ajouté pour minimiser
l'effet de dilution. Le suivi est effectué par conductimétrie.
L'agitation est mise en route.
La solution de soude de concentration CB=0,1 mol/L est placée dans la burette, puis ajoutée mL par mL. La conductivitée est relevée après stabilisation.
L'étalonnage de la cellule n'est pas indispensable puisque c'est l'allure de la courbe qui nous intéresse.
| V en mL | σ en mS/cm |
|---|---|
| 0 | 1961 |
| 1 | 1821 |
| 2 | 1674 |
| 3 | 1530 |
| 4 | 1387 |
| 5 | 1248 |
| 6 | 1114 |
| 7 | 970 |
| 8 | 838 |
| 9 | 706 |
| 10 | 584 |
| 11 | 614 |
| 12 | 713 |
| 13 | 805 |
| 14 | 903 |
| 15 | 990 |
| 16 | 1089 |
| 17 | 1160 |
| 18 | 1240 |
| 19 | 1334 |
| 20 | 1438 |
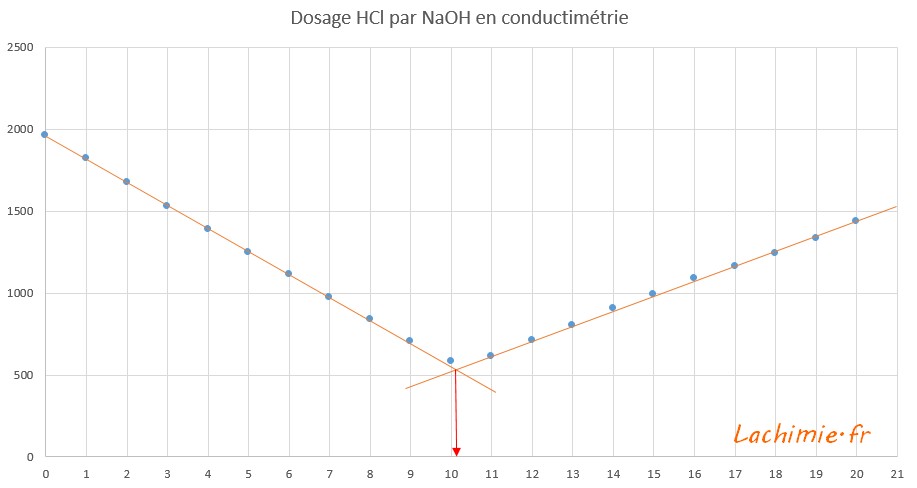
Le tracé de la conductivite σ en fonction du volume de soude versé VB permet de déterminer le point équivalent. Pour cela, il suffit de tracer les deux segments de droite. Le point équivalent est obtenu à l'intersection des deux droites. Pour plus de détails sur le principe du dosage et l'nterprétration de l'allure de la courbe, consultez la page explicative sur le titrage conductimétrique.
Calcul de la concentration
A l'équivalence, le volume versé de soude est égal à VB = 10,2 mL
D'après la relation de la réaction, on a CAVA = CBVB
d'où CA = CBVB/VA
Application numérique: CA=0,1x10,2/10 = 0,102 mol/L