Dosage de l'eau de Javel
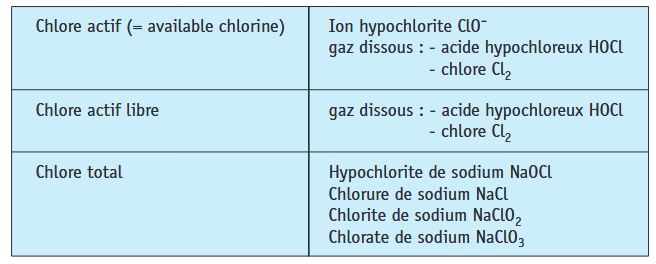
L’eau de Javel est une solution aqueuse d’hypochlorite de sodium (Na+ + ClO-) et de chlorure de sodium (Na+ + Cl-). Selon les pays, sa concentration s'exprime de deux façons différentes :
- en degré chlorométrique
- en pourcentage de chlore actif
Le degré chlorométrique (de Gay Lussac) correspond au volume, exprimé en litre, mesuré à 0°C, sous la pression de 1,013 bar, de dichlore obtenu par réaction totale de l’ion hypochlorite en milieu acide selon la réaction:
Cl-(aq) + ClO-(aq) + 2 H+(aq) → Cl2(g) + H2O (E° = 1,611 V)
Il est indépendant de la densité de la solution et s'écrit en abrégé °chl..
1 litre d'eau de Javel à 36° chlorométrique libère 36 L de dichlore.
Le volume molaire gaz étant égal à 22,4 L on obtient : 36/22.4 = 1.607 mole de Cl2 = 114,1 g de Cl2.
Détermination du titre chlorométrique
Le titre chlorométrique de l’eau de Javel peut être déterminé par dosage.
Principe du dosage de l’eau de Javel
Le dosage s’effectue généralement par iodométrie : On ajoute un excès d’ions I- qui vont être oxydés par les ions hypochlorites ClO- suivant la réaction bilan:
Le diiode formé est ensuite dosé par du thiosulfate de sodium suivant la réaction :
Demi-réaction mises en jeu dans le dosage:
ClO- + 2 H+ + 2 e- ⇌ Cl- + H2O (E° = 1,482 V)
I2 + 2 e- ⇌ 2 I- (E° = 0,535 V)
S4O62- + 2 e- ⇌ 2 S2O3- (E° = 0,08 V)
En pratique au laboratoire
On prélève à l’aide d’une pipette jaugée un volume précis d’eau de Javel que l’on place dans un bécher. On rajoute à l’éprouvette un excès d’iodure de potassium (KI) puis de l'acide éthanoïque. On dose le diiode formé par du thiosulfate de sodium préalablement placé dans la burette. Le point équivalent est mis en évidence par l'ajout dans le bécher d’empois d’amidon lorsque la solution est jaune paille. L’équivalence est repéré au changement de teinte de bleu à l’incolore.