L'oxydoréduction et les couples rédox
Définitions de l'oxydoréduction
Les réactions d'oxydoréduction sont des réactions dans lesquelles se produisent des transferts d'électrons entre les réactifs.
Une oxydation est une perte d'électron. C'est le cas par exemple du passage de Cu à Cu2+
Inversement, une réduction est un gain d'électron. Dans le cas du cuivre, cela correspond au passage de Cu2+ à Cu.
On appelle les réactifs qui perdent des électrons des réducteurs, ceux qui en gagnent sont des oxydants.
Les oxydants et les réducteurs forment des couples rédox ox./réd. Le potentiel standard s'écrit sous sa forme générale Eox./red. Il est ainsi aisé de repérer l'oxydant et le réducteur.
L'équilibre d'un couple rédox est de la forme:
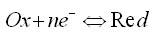
avec n le nombre d'électrons mis en jeu
Dans le sens Ox + ne- → Red: l'oxydant se réduit
Dans le sens Red → Ox + ne-: le réducteur s'oxyde
On appelle une réaction d'oxydo-réduction une réaction où deux couples rédox sont mis en jeu où la règle du gamma permet de prévoir le sens de la réaction.
Exemple de couples rédox
La confusion règne souvent dans l'esprit des lycéens entre oxydants et réducteurs. Voici un l'exemple du couples Cu2+/Cu pour revoir l'ensemble de ces notions.
Par analogie avec la forme générale du couple rédox Ox/Red, il apparaît dans le cas du couple Cu2+/Cu que :
- la forme Cu2+ est l'oxydant
- la forme Cu est le réducteur
- le passage de Cu2+ à Cu est une réduction (gain d'électron)
- le passage de Cu à Cu2+ est une oxydation (perte d'électron)
On peut donc écrire l'équilibre du couple rédox: